Gazlar içine konuldukları kabın şeklini alır, kaptaki gaz molekülleri kabın duvarlarına çarparak basınç uygular. Kapalı kaplardaki gaz basıncı nelere bağlıdır sorusunun cevabını en iyi özetleyen formül ideal gaz kanunudur:
PV = nRT
P basınç,
V hacim,
n tanecik sayısı,
R ideal gaz sabiti (bu denklemdeki değişmeyen tek şey budur),
T sıcaklık demektir.
Dolayısıyla gaz basıncı hacme, tanecik sayısına ve sıcaklığa bağlı olarak değişir. Bazı durumlarda bu değişkenlerden bazıları sabit olabilir, o zaman gaz basıncı sadece sabit olmayan değişkenlere bağlı olarak değişir.
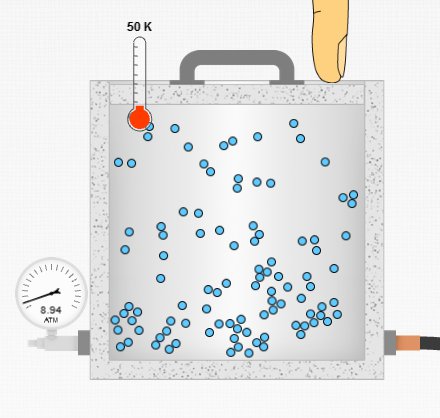
Yukarıdaki resimde kapalı bir kaptaki basıncı atm biriminden ölçen bir basınç ölçer, gazın sıcaklığını ölçen bir termometre, kabın hacmini değiştirebilen bir kapak ve gaza daha fazla tanecik ekleyebilen pompanın borusu görülüyor. 50 K sıcaklıkta ve ilk hacimde basıncın 8,94 atm olmuş. Bu resmi aşağıdaki diğer resimlerle kıyaslayacağız.
Hacim ve sıcaklık sabitse gaz basıncı nelere bağlı olur?
İdeal gaz denklemi şu biçime dönüşür:
P = \frac{RT}{V}n \frac{RT}{V} = sabit P = (sabit)nYani sıcaklığın ve hacmin sabit tutulduğu kapalı bir kapta gaz basıncı sadece tanecik sayısına (n) bağlıdır. Bu durumda basınç ve molekül sayısı doğru orantılıdır.
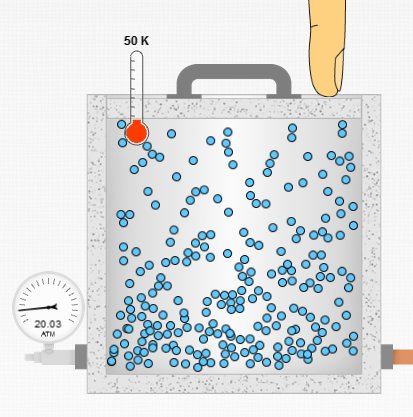
Yukarıdaki resimde sıcaklık 50 K’de hacim ilk hacimde sabit tutulmuş, sadece daha fazla molekül eklenmiş. Basıncın 20 atm’ye çıktığı görülüyor. Bir önceki resme göre basınç artmış.
Hacim ve molekül sayısı sabit olursa gaz basıncı nelere bağlı olur?
İdeal gaz denklemi bu kez şöyle yazılır:
P = \frac{Rn}{V}T \frac{Rn}{V} = sabit P = (sabit)TYani hacmin ve molekül sayısının sabit olduğu durumda kapalı bir kaptaki gazın basıncı yalnızca sıcaklığa (T) bağlıdır. Bu durumda basınç ve sıcaklık doğru orantılıdır.
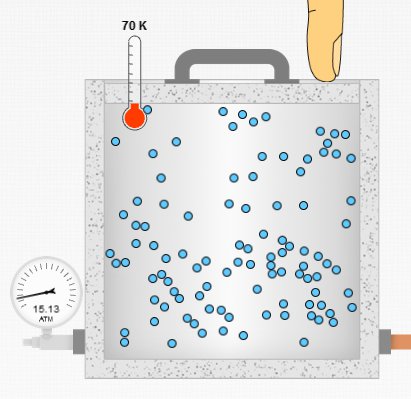
Yukarıdaki resimde hacim ve molekül sayısı sabit tutulurken sıcaklığın 50 K’den 70 K’ye çıkarıldığı durum gösteriliyor. Gazın basıncı 15 atm’ye çıkmış.
Sıcaklık ve molekül sayısı sabit olursa gaz basıncı nelere bağlı olur?
Bu durumda ideal gaz denklemi şöyle olur:
P = RnT\frac{1}{V} RnT = sabit P = (sabit) \frac{1}{V}Yani sıcaklık ve molekül sayısının sabit olduğu kapalı bir kaptaki gazın basıncı sadece hacme (V) bağlıdır. Bu durumda basınç ve hacim ters orantılıdır, hacim arttıkça basınç azalır.
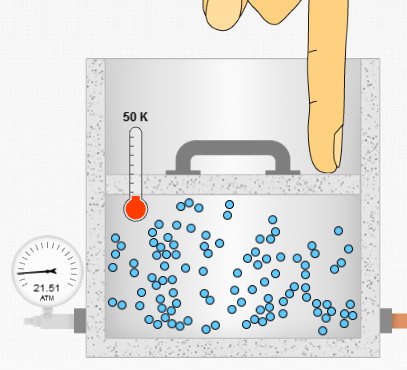
Aşağıdaki resimde sıcaklık ve molekül sayısı sabit tutulup, hacmin azaltıldığı durum gösteriliyor. Hacim kabın kapağı bastırılıp azaltılınca basınç 21,5 atm’ye yükselmiş.
Boyle – Mariotte Yasası
Tanecik sayısı ve sıcaklığı sabit olan bir gazın basınç ve hacim çarpımı sabittir. Bu ilişki Boyle yasası ya da Boyle – Mariotte kanunu olarak bilinir.
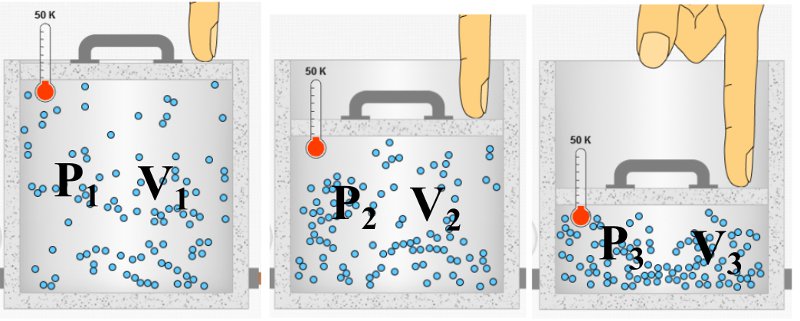
Yukarıdaki resimde aynı sıcaklıkta bir miktar gazın üç farklı hacim durumu gösteriliyor. Her üç durumda da basınç ve hacim çarpımı sabit olmak zorunda, bu şöyle ifade edilebilir:
P1V1 = P2V2 = P3V3
Dalton yasası
Dalton yasası bir kabın içindeki birbiriyle tepkimeye girmeyen gazların kısmi basınçlarının toplamının, kabın içindeki toplam gaz basıncına eşit olacağını ifade eder. Dalton yasasının formülü iki gaz için şöyledir:
Ptoplam = P1 + P2

Yukarıdaki resimde iki farklı kapta iki ayrı gaz görülüyor. Gazların birbirine karışmasını bir musluk engelliyor. Gazların tanecik miktarı ve sıcaklık sabitken musluk açılırsa son basınç ne olur?
Boyle yasasına göre her iki gaz için de PV çarpımları sabittir. Öyleyse:
P_{1 \space son}V_{son} = P_1V_1 P_{2 \space son}V_{son} = P_2V_2Şimdi iki denklemi taraf tarafa toplayalım:
(P_{1 \space son} + P_{2 \space son})V_{son} = P_1V_1 + P_2V_2Şimdi de Dalton yasasını yazalım:
P_{son} =P_{1 \space son} + P_{2 \space son}Bir önceki denklemde yerine koyalım, bu durumda:
P_{son}V_{son} = P_1V_1 + P_2V_2Esnek balonlarda gaz basıncı
Bir plastik çocuk balonu şişirildiğinde içindeki gaz için esnek bir kapalı kap görevi görür. Balonun iç basıncı daima dış basınca eşit olur. Balonun içine yeni tanecik eklenmez ve sıcaklık sabit tutulursa, dış basınç artarsa balonun iç basıncının da dengeleyecek şekilde artması gerekir. Bu durumda Boyle yasasına göre balonun hacmi azalır. Eğer dış basınç azalırsa, iç basıncın da azalması için balonun hacmi artar.
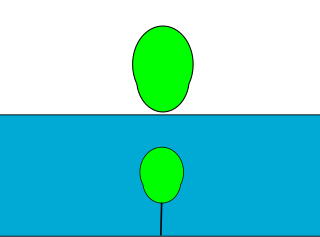
Örneğin, yukarıdaki resimde bir balon su dolu bir kabın içine bir iple bağlanmış. Suyun basıncı balonun iç basıncına eşit. Sonra ip kesiliyor ve balon suyun dışına çıkıyor. Suyun dışında artık dış basınç sadece açık hava basıncına eşit, yani ilk durumdan daha az. Bu nedenle balonun hacmi büyümüş.
Gaz Basıncı ile ilgili Fizik Kazanımları
10.2.1.1. Basınç ve basınç kuvveti kavramlarının katı, durgun sıvı ve gazlarda bağlı olduğu değişkenleri açıklar.
- Öğrencilerin, günlük hayattan basıncın hayatımıza etkilerine örnekler vermeleri sağlanır. Basıncın hâl değişimine etkileri vurgulanır.
- Katı ve durgun sıvı basıncı ve basınç kuvveti ile ilgili matematiksel hesaplamalar yapılmaz.
- Torricelli deneyi açıklanır ve kılcallık ile farkı belirtilir.
- Basınç etkisiyle çalışan ölçüm aletlerinden barometre, altimetre, manometre ve batimetre hakkında bilgi verilir.
- Gaz basıncında ve Pascal Prensibi’nde matematiksel hesaplamalara girilmez.
Farklı görsel ve videolarla zenginleştirilmiş olması akılda kalıcı oluyor.Çok teşekkür ederim sitenize bayıldım.
Beğenmenize sevindim.
Çok hoş hazırlanmış,Ellerinize sağlık,gayet öğretici olmuş.Teşekkürler!
Çakmak gaz basıncına girer mi??????lütfen aciiiil ?
hayır
Biraz fazla detaylı kafa karıştırıcı
Kafan nerelerde karıştı?
her şeyde
Gerçekten konuyu(konuları) çok iyi,akılda kalıcı ve akıcı anlatmanız çok hoş. Başarılarınızın devamını dilerim…
Merhaba balonun şişirilmiş halinde iç basınç, açık hava basıncıyla birlikte, balonun esnak olmasından dolayı içindeki gaza uyguladığı kuvveti de dengelemiş olmuyor mu?
dostum bende merak etmiştim bunu, sorunun cevabı normal şartlarda evet ama burada balonun esneklik enerjisini görmezden geliyoruz kimya dersinde gördüğümüz sistemler yaptığımız işlemler ideal sistemlerle varsayımsal olarak yapılıyor yani bu tür etkenleri(pistonlu kaplardaki sürtünmeler balonun esnekliği vs.)hesaplamalara dahil etmiyoruz .
çok güzel başarılarınızın devamını beklerim:):):):)
????
çok güzel olmuş projemde çok işe yarar
Sabit sıcaklıkta kapalı bir kaptaki gazın basıncı mol kütlesine bağlı mıdır?
evet kanki p.v=n.R.t n dekıi mol kapalı kaptada geçerli
Çok güzel açıklanmış performans ödevime yardım ettiğiniz için teşekkürler