Maddenin katı, sıvı ve gaz hallerini biliyoruz. Belirli sıcaklıklarda saf bir maddenin hal değiştirdiğini de biliyoruz. Katıdan sıvıya geçmeye erime, sıvıdan katıya geçmeye donma olayı, bu olayların gerçekleştiği sıcaklığa normal erime ve donma noktası diyoruz. Benzer şekilde saf bir maddenin sıvıdan gaza kaynayarak dönüştüğünü ve gazdan sıvı hale de yoğuştuğunu söylüyoruz. Ama şimdiye kadar yalnızca sıcaklıklardan bahsediyorduk, normal koşullarda erime ve kaynama noktasından bahsetmiştik. Bunun anormal olanı da var demek ki. Basıncın hal değişimine etkisi nedir sorusunun cevabını ezber olarak öğrenmiş olabilirsiniz. Bu yazıda mantığını öğreneceksiniz.
Ders kitabınızda “su hariç diğer tüm maddeler yüksek basınçta normale göre daha yüksek sıcaklıkta erir çünkü yüksek basınç maddenin taneciklerini sıkıştırarak bir arada kalmalarını kolaylaştırır”. Peki su neden bu kurala uymuyor? Buna verilen cevap ampirik (deneysel) olarak bu sonuca ulaştığımız: gözlemlerimiz suyun diğer saf maddelerden farklı davrandığını gösteriyor. Su katı haldeyken (yani buz iken) özkütlesi sıvı haldekinden daha az, yani soğuyunca genleşiyor, hacmi artıyor.
Basıncın hal değişimiyle ilişkisini anlayabilmemiz için önce hal diyagramları ya da faz diyagramları neymiş öğrenmemiz gerekiyor.
Faz Diyagramı nedir? Üçlü nokta nedir?
Bir saf maddeyi kapalı bir kaba koyup basıncı ve sıcaklığı değiştirerek maddenin hallerini gözlemlerseniz, bu üç değişken arasında bir ilişki kurabilirsiniz. Binlerce veri noktası alındığını hatırlatalım. Bu veriyi eğer bir tabloda göstermek isteseydik şöyle görünebilirdi:
| Gözlem sırası | Basınç (kPa) | Sıcaklık (K) | Haller |
| 1 | 0,01 | 20 | katı |
| 2 | 0,02 | 22 | katı |
| . | . | . | . |
| . | . | . | . |
| 10000 | 500 | 600 | gaz |
Sadece tabloya bakarak bu kadar çok veriye anlam vermek mümkün görünmüyor. İşte bu nedenle değişkenler arasında kurduğunuz ilişkileri göstermenin en iyi yollarından bir grafikler ya da diyagramlar kullanmaktır. Hal değişimi diyagramı (ya da faz değişimi diyagramı) basınç, sıcaklık ve maddenin halleri ile ilgili gözlemleri özetleyen bir grafiktir. Maddenin yalnızca katı, sıvı ve gaz halleri gösteriliyor; maddenin plazma hali faz diyagramında gösterilmiyor.
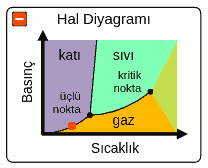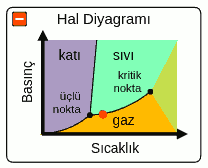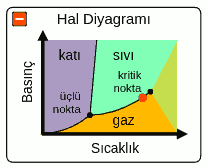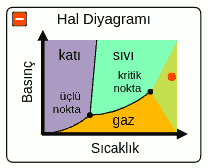
Aşağıdaki resimde çoğu saf madde için geçerli olan bir faz diyagramı var. Bu diyagramı birlikte inceleyelim.
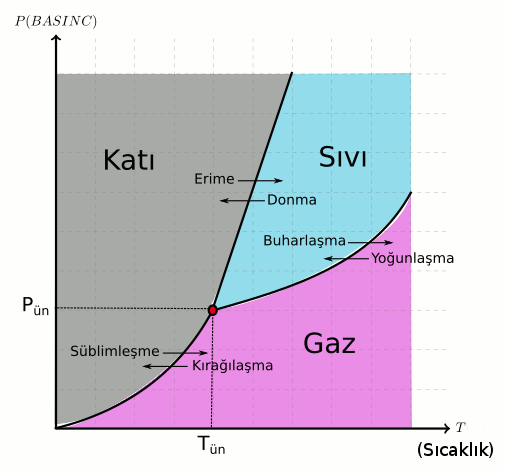
Faz grafiğinde iki eksen var. Yatay eksen sıcaklığı, dikey eksen basıncı gösteriyor. Sağa doğru gittikçe sıcaklık artıyor, yukarı doğru gittikçe basınç artıyor. Bu diyagram bize herhangi bir (P,T) yani basınç ve sıcaklık değerinde maddenin hangi halde olduğunu gösteriyor. Basınç yüksek sıcaklık düşük olduğu zaman madde katı hal bölgesinde. Basınç düşük sıcaklık yüksek olduğu zaman da madde gaz bölgesinde. Orta basınç ve sıcaklıkta ise maddenin sıvı bölgesinde olduğunu görüyoruz.
Grafikte kalın çizgilerin bir yanından öbür yanına geçmek hal değişimi anlamına geliyor. Örneğin, grafiğin sol alt köşesinde (katı bölgeden) kalın çizginin sağına (gaz bölgesine) geçerseniz (yani sabit basınçta sıcaklığı artırırsanız) katıdan gaza geçmiş oluyorsunuz, buna süblimleşme deniyor. Süblimleşmenin sabit sıcaklıkta basıncı artırarak da olabildiğine dikkat edin. Bu durumda grafikte düz bir çizgiyi izleyerek aşağıdan (gaz bölgesinden) yukarı (katı bölgesine) çıkınca da kalın çizgiyi geçiyoruz. Katıdan sıvıya (erime), sıvıdan katıya (donma), sıvıdan gaza (buharlaşma), gazdan sıvıya (yoğunlaşma) ve gazdan katıya (kırağılaşma) geçmek mümkün.
Faz diyagramında yalnızca bir noktada (P,T değerinde) her üç hal (katı, sıvı ve gaz hali) aynı anda gözleniyor ve bu noktaya (yani bu noktadaki basınç ve sıcaklık değerlerine) o maddenin üçlü noktası deniyor. Diyagramdaki kırmızı nokta bu madde için üçlü nokta, (Pün (üçlü nokta), Tün (üçlü nokta)) ile gösterilmiş.
Son olarak gaz bölgesiyle hem katı hem de sıvı bölgesini ayıran sürekli bir sınır çizgisi olduğunu fark etmemiz gerekiyor. Bunun anlamı çizginin üzerindeki değerlerde katı ve gaz veya sıvı ve gaz hallerinin aynı anda gözlemlenmesi. Bu buhar basıncıyla ilişkili ama o konuya girmeyeceğiz.
Genel Faz Diyagramından Basıncın hal değişimine etkisi ile ilgili çıkan sonuçlar
Çoğu madde için geçerli olan faz diyagramından şu sonuçlara ulaşabiliriz:
- Katıdan gaza geçerken (süblimleşmede) basınç arttıkça sıcaklık da artıyor. Daha çok basınç uygulanırsa süblimleşme daha yüksek sıcaklıkta gerçekleşiyor. Gazdan sıvıya geçerken de (kırağılaşmada da) aynı sonuç geçerli.
- Katıdan sıvıya geçerken (erimede) basınç arttıkça sıcaklık da artıyor. Yüksek basınç uygulandığında erime yüksek sıcaklıkta gerçekleşiyor. Sıvıdan gaza geçişte de (donmada da) aynı sonuca varıyoruz.
- Sıvıdan gaza geçerken (buharlaşmada) basınç arttıkça sıcaklık da artıyor. Tıpkı diğer hal değişimlerinde olduğu gibi buharlaşma ve yoğunlaşmada da yüksek basınç yüksek sıcaklık gerektiriyor.
Suyun faz diyagramı
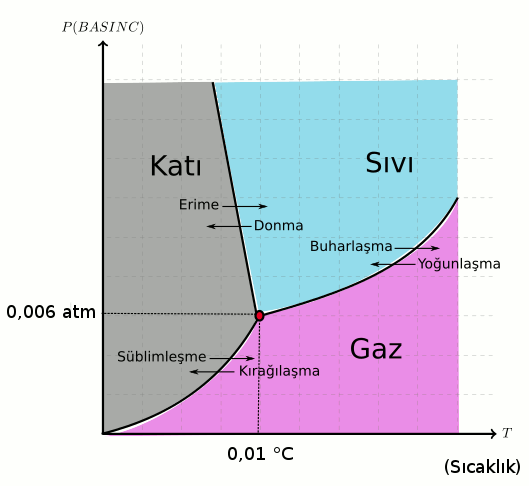
Bir önceki faz diyagramının çoğu saf madde için geçerli olduğunu söylemiştik, hepsi için geçerli dememiştik, çünkü değil. Suyun faz diyagramında önemli bir fark var. Yukarıdaki resimde suyun (H2O) faz diyagramı gösteriliyor. Gelin suyun faz diyagramını birlikte inceleyelim.
Bu grafik eğitimsel amaçlarla biraz abartılmış, katı ile sıvı bölgesini ayıran çizginin eğimi o kadar fazla değil, ama hala eğim var. Bir önceki genel faz diyagramıyla suyunkini karşılaştırırsak ne görürüz? Çok benziyor değil mi, neredeyse aynı. Ama aynı değil. Katı ile sıvı bölgesini ayıran siyah kalın çizgi çoğu madde için pozitifti (sağa doğru eğimliydi), suda ise negatif (sola doğru eğimli). Bu önemli fark basıncın hal değişimine etkisinde suyu diğer maddelerden ayıran fark. Ne demek peki bu?
Katıdan sıvıya (erime) veya sıvıdan katıya (donma) geçerken su için basınç arttıkça sıcaklık azalıyor. Bu sonuç diğer maddelerin tam zıttı. Diğer maddelerde erime ve donma için basınç arttıkça sıcaklık da artıyordu. Yani buzu yüksek basınç uygularsanız normal koşullara göre (1 atm basınca göre) daha düşük sıcaklıkta eritebilirsiniz. Tersi de doğru düşük basınçta buz 0 °C’nin üstünde eriyor, dağların tepelerinde yazın bile kar kalmasının nedeni de bu.
Suyun diğer hal değişimleri ise (süblimleşme ve buharlaşma) diğer maddelerle aynı özellikleri gösteriyor. Basınç arttıkça hal değişimi (unutmayın erime ve donma hariç) için gereken sıcaklık da artıyor.
Son olarak suyun üçlü noktasının (Pün = 0,006 atm , Tün = 0,01 °C olduğunu görüyoruz. Yani 0,006 atm (611 Pa) basınçta ve 0,01 °C’de hem buz, hem su hem de su buharı aynı anda bulunuyor. Kelvin sıcaklık ölçeği suyun üçlü noktasına göre tanımlanıyor. 1 K = (suyun üçlü noktasının sıcaklığı) / 273,16 olarak tanımlanıyor. Bu noktanın seçilmesinin nedeni biricik olması, başka hiçbir basınç ve sıcaklık durumunda suyun her üç hali aynı anda gözlemlenmiyor.
Basıncın hal değişimine etkisi ile ilgili günlük hayattan örnekler
Günlük yaşamda basıncın hal değişimine etkisi en sık yemek pişirirken karşımıza çıkıyor. Düdüklü tencerelerde basınç artırıldığı için su 100 °C’tan daha yüksek sıcaklıkta kaynıyor. Böylece yemekler daha çabuk pişiyor.

Ayrıca yükseklik arttıkça açık hava basıncı azaldığı için dağcılar yemeklerini pişirmekte zorlanıyorlar. Çünkü basınç azaldıkça suyun kaynama sıcaklığı azalıyor. Aşağıdaki videoda bir dağcının Everest tepesine çıkarken farklı rakımlarda suyun kaynama noktasını ölçtüğü gösteriliyor. Deniz seviyesinden 1300 metre yüksekte su 97 °C’de, 3500 metre yükseklikte 91 °C’de, 5300 metrede 82 °C’de suyun kaynadığını görüyoruz.
Basıncın azalmasıyla kaynama noktasının da düşmesine bir örnek de aşağıdaki videoda gösteriliyor. Kapalı bir kaptaki hava bir vakum pompasıyla çekilince, kabın içindeki basınç düşüyor. Su oda sıcaklığında (25 °C) kaynamaya başlıyor.
Aşağıdaki videoda metal bir tele ağırlık bağlanarak bir buz kalıbına yüksek basınç uygulanıyor. Tel buzun 0 °C’nin altında bir sıcaklıkta erimesini sağlayan basıncı uyguluyor böylece buzu kesiyor.
Basıncın hal değişimine etkisi ile ilgili Simülasyon
Maddenin Halleri Temel İlkeler PHET Simülasyonunun “Hal Değişimleri” sekmesinde neon, argon, oksijen ve su için faz diyagramını görebilirsiniz. Kapalı kaptaki maddeyi ısıttıkça hal diyagramında basınç ve sıcaklık noktasının nasıl değiştiğini gözlemleyebilirsiniz. Aşağıdaki resim oksijenin ısıtırlırken faz diyagramını gösteriyor.
Basıncın hal değişimine etkisi ile ilgili kazanımlar
10.2.1.1. Basınç ve basınç kuvveti kavramlarının katı, durgun sıvı ve gazlarda bağlı olduğu değişkenleri açıklar.
- Öğrencilerin, günlük hayattan basıncın hayatımıza etkilerine örnekler vermeleri sağlanır. Basıncın hâl değişimine etkileri vurgulanır.
Çok güzel bir site. Epey anlaşılır bir dili var bundan sonra hep burdayım.
10 numara * * * * * diyorum baba başaka da bir şey demiyorum
Gerçekten konuyu anladım. Teşekkür ederim.