Erime noktası ya da erime sıcaklığı saf bir maddenin belli bir basınçta katı halden sıvı hale geçtiği sıcaklıktır. Donma noktası ya da sıcaklığı maddenin sıvı halden katı hale değiştiği sıcaklığa denir. Erime ısısı saf bir maddenin katı halden sıvı hale geçmesi için birim kütlesine sağlanması gereken enerji miktarıdır. Donma ısısı da sıvı haldeki saf bir maddenin katı hale dönüşmesi için çevreye vermesi gereken enerjidir. Şimdi bu kavramları daha ayrıntılı inceleyelim.
Erime noktası (sıcaklığı) nedir?
Katı halde bulunan saf bir maddeye ısı verildiğinde önce sıcaklığı artar. Ama belli bir sıcaklığa eriştiğinde sıcaklık artışı durur ve madde erir. Erime belirli bir basınçta, yalnızca belirli bir sıcaklıkta gerçekleşir. Bu sıcaklığa erime sıcaklığı ya da erime noktası denir. Erime sürecinde maddenin sıcaklığı değişmez. Maddeye verilen enerji, tanecikleri arasındaki çekim kuvveti yenmek için kullanılır. Bu nedenle taneciklerin ortalama kinetik enerjileri sabit kalır. Sıvı hale dönüşen maddenin tanecikleri artık belirli bir konuma sahip olmaz ve titreşim hareketinin yanı sıra öteleme hareketi de yapar.
Erime noktası her madde için farklı bir değerdedir, bu nedenle maddenin ayırt edici bir özelliğidir.
Donma noktası (sıcaklığı) nedir?
Sıvı halde bulunan bir saf madde çevreye ısı verdiğinde enerjisi azalır ve donar. Donma da sadece belirli bir sıcaklıkta olur. Bu sıcaklığa donma noktası ya da donma sıcaklığı denir. Donma olayı esnasında maddenin sıcaklığı sabit kalır. Maddenin çevreye verdiği enerji taneciklerinin hareketinin yavaşlamasına değil, taneciklerin birbirine yaklaşmasına ve sabit konumlara gelmelerine neden olur. Maddenin molekülleri arasındaki çekim kuvveti artar. Artık katı hale dönüşen maddenin tanecikleri yalnızca titreşim hareketi yapar.
Aynı saf madde için aynı basınçta erime ve donma sıcaklıkları birbirine eşittir. Örneğin, suyun donma noktası da erime noktası da 1 atmosfer basınçta 0 °C’dir.
Basınç ile erime noktası ilişkisi nedir?
Bir çok saf madde için katı haldeyken maddeye uygulanan basınç arttığında erime sıcaklığı artar. Yüksek basınç altında daha yüksek sıcaklıkta erir ve donar. Ancak su erime ve donma ile basınç ilişkisi açısından bir çok maddeden farklıdır. Su için basınç arttıkça erime ve donma sıcaklığı azalır. Örneğin, buz yüksek basınç uygulandığında 0 °C’nin altında erir. Eğer basıncı artırıp buzu daha düşük sıcaklıkta eritirseniz, sonra basıncı azaltırsanız suya dönüşen buz tekrar buz olur. Bu olaya çözülme ve donma (regelation) denir. Bir buz kalıbının üstüne ince bir tel yerleştirip, telin iki ucuna ağırlık bağlarsanız, telin uyguladığı basınçtan dolayı buz 0 °C’den daha düşük sıcaklıkta erir. Telin uyguladığı basınç ortadan kalkınca su tekrar donar. Buz pateninin çalışmasıyla bu olayın ilişkisi olduğunu öne sürenler var, ama doğru değil. Buz patencinin uyguladığı basınç suyun erime noktasını 1 °C bile düşürmeye yetmiyor (Kaynaklardan inceleyebilirsiniz). Aşağıdaki video bu olayı gösteren bir deneyi gösteriyor.
Ayrıca basınç azaldığında suyun erime noktası artar, buz 0 °C’de değil bu sıcaklığın üstünde erir. Aşağıdaki resimde görülen yüksek dağın zirvesindeki karın erimemesinin nedeni açık hava basıncının düşük olması, dolayısıyla buzun erime noktasının artmasıdır. Basınç ile hal değişimi arasındaki ilişkinin ayrıntılı anlatımı burada.

Erime ısısı nedir?
Saf bir maddenin katıdan sıvıya dönüşmesi için sağlaması gereken enerjinin birim kütleye oranına erime ısısı adı verilir. Le simgesiyle gösterilir. Skalerdir ve türetilmiş bir büyüklüktür. Erime ısısının birimi cal/g ya da J/kg olarak belirtilir.
Erime ısısı her madde için farklı bir değer alır, bu yüzden maddenin ayırt edici bir özelliğidir.
Basıncın erime ısısına etkisi ihmal edilebilecek kadar azdır.
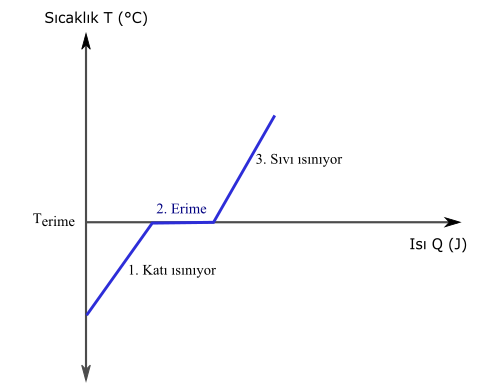
Yukarıdaki ısı sıcaklık grafiği saf bir maddeye ısı verildiğinde ne olduğunu gösteriyor:
1. Madde katı haldeyken ısı verilince sıcaklığı artıyor.
2. Erime noktasına (Terime) ulaştığında maddeye ısı verilmesine rağmen sıcaklığı değişmiyor, ama eriyor.
3. Erime tamamlandıktan sonra yani maddenin tümü katı halden sıvı hale geçtikten sonra, ısı verilmeye devam edildiği için, sıvı haldeki maddenin sıcaklığı artmaya devam ediyor.
Bir saf maddenin erimesi için verilmesi gereken ısı miktarıyla erime ısısının ilişkisinin formülü şöyledir.
Q = mLe
Q verilen ısıyı, m maddenin kütlesini gösterir.
Donma ısısı nedir?
Saf bir maddenin sıvı halden katı hale geçmesi için çevresine vermesi gereken ısının birim kütleye oranına donma ısısı denir. Ld simgesiyle gösterilir. Erime ısısı gibi, donma ısısının da birimi cal/g ya da J/kg‘dir.
Aynı saf madde için donma ısısı, erime ısısına eşittir.
Ld = Le
Örneğin, suyun erime ve donma ısısı 80 cal/g ya da 2000 J/kg’dır.
Isının yönü her zaman sıcaklığı yüksek olan sistemden sıcaklığı düşük olana doğrudur. Bu nedenle sıvı haldeki bir madde erirken çevresine enerji aktarır, kendi iç enerjisi azalır. Buzluğa bir bardak su koyduğunuz zaman buzluk suyu soğutmaz, su buzluğu ısıtır (Bu ne demek bir düşünün.) Günlük dilde pencereyi kapat içeri soğuk girmesin diyebiliriz. Ama fiziğe göre içeri giren soğuk değildir, dışarı kaçan sıcaktır.
Çeşitli maddelerin erime noktaları ve erime ısıları
| Madde türü | Erime noktası (°C) | Erime ısısı (kJ / kg) | Erime ısısı (cal / g) |
|---|---|---|---|
| Alüminyum | 660 | 397 | 95 |
| Bakır | 1083 | 134 | 32 |
| Demir | 1808 | 289 | 69 |
| Etil alkol | -114 | 104 | 25 |
| Gümüş | 960 | 88 | 21 |
| Kurşun | 327 | 25 | 6 |
| Su | 0 | 333 | 80 |
| Galyum | 30 | 80 | 19 |
| Cıva | -39 | 11 | 3 |
Erime ve donma ısısı örnek soru ve çözümü
Bir kalorimetre kabında 1 atmosfer basınçta, sıcaklığı -20 °C olan 100 g kütleli buz parçasına ısı verilerek tamamen erimesi sağlanıyor. Bu işlem süresince buz parçasına aktarılan enerji kaç J’dür? (Buzun öz ısısı, cbuz = 2100 J/kg ve erime ısısı, Le buz = 333 kJ/kg)
Çözüm:
Önce sürecin ısı sıcaklık grafiği çizmemiz lazım. Böylece ne zaman ne oluyor daha rahat görebiliriz. Başlangıçta elimizde -20 °C sıcaklıkta buz var. Isı verilince önce buzun sıcaklığı artacak, sonra su buza dönüşecek, yani eriyecek. Buzun erime sıcaklığının 0 °C olduğunu biliyoruz.
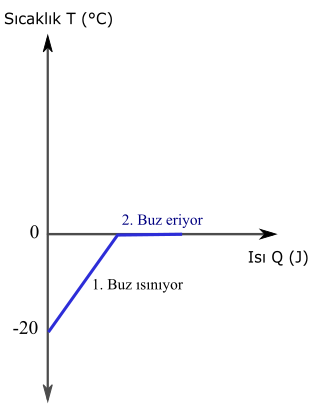
1. Buz ısınırken sağlanan ısı:
Q1 = mcbuzΔT
ΔT = Tson – Tilk
ΔT = 0 °C – (-20 °C) = +20 °C
m = 100 g = 0,1 kg
Q1 = 0,1 kg x 2100 J/kg x 20 °C
Q1 = 4200 J
2. Buz erirken sağlanan ısı:
Q2 = mLe buz
m = 0,1 kg (buzun tamamı eriyor)
Q2 = 0,1 kg x 333 kJ/kg = 33,3 kJ
Kilojoule’ü joule dönüştürmeyi unutmamalıyız.
Q2 = 33300 J
Buzu eritmek ısıtmaktan daha çok enerji gerektirdi.
Şimdi toplam ısıyı bulalım:
Qtoplam = Q1 + Q2
Qtoplam = 4200 J + 33300 J = 37500 J
Erime ve donma noktası ve ısısı ile ilgili Kazanımlar
9.5.2.1. Saf maddelerde hâl değişimi için gerekli olan ısı miktarının bağlı olduğu değişkenleri analiz eder.
- Deney veya simülasyonlardan yararlanarak değişkenler arasındaki ilişkiyi belirlemeleri sağlanır. Matematiksel model verilir. Matematiksel hesaplamalara girilmez.
Q2 = 0,1 kg x 333 J/kg = 33,3 kJ burada 333 j/kg yazık cevapta kj olarak yazmışsınız eğer alttaki gibi devam edecekse kj/kg olarak değiştirmelisiniz
Dikkatiniz harika. Düzeltildi.
çok iyi
Basınç erime sıcaklığını değiştiriyorsa erime ısısını neden değiştirmiyor? Erime sıcaklığı erime ısısıyla alakalı bir şey değil mi
Erime ısısı saf ve erime sıcaklığındaki bir maddenin katı halden sıvı hale geçmesi adına tanecikler arası çekim kuvvetinin azalmasını sağlamak amacıyla maddeye sağlanması gereken ısı miktarıdır.
Yani erime ısısı denince maddeyi erime sıcaklığına getirmek amacıyla verilmesi gereken ısı aklımıza gelmemeli sanırsam.