Kaynama noktası ya da sıcaklığı saf bir maddenin belli bir basınçta sıvı halden gaz haline geçtiği sıcaklıktır. Yoğunlaşma (yoğuşma) noktası ya da sıcaklığı maddenin belirli bir basınçta gaz halinden katı hale dönüştüğü sıcaklıktır. Buharlaşma ısısı saf bir maddenin sıvı halden gaz haline geçmesi için sağlanması gereken enerji miktarının birim kütlesine oranıdır. Yoğunlaşma ısısı da gaz halindeki bir maddenin sıvı hale dönüşmesi için çevreye vermesi gereken enerji miktarıdır.
Kaynama noktası (sıcaklığı) nedir?
Sıvı haldeki bir saf maddeye enerji verildiğinde maddenin sıcaklığı artar. Ancak bir süre sonra sıcaklık değişmemeye ve madde kaynamaya başlar. Kaynama belli bir basınçta, sadece belli bir sıcaklıkta meydana gelir. Bu sıcaklığa kaynama sıcaklığı ya da kaynama noktası denir. Kaynama süreci boyunca maddenin sıcaklığı sabit kalır. Maddeye verilen enerji, sıvının tanecikleri arasındaki çekim kuvvetini aşmak için kullanılır; taneciklerin ortalama kinetik enerjileri değişmez. Gaz haline dönüşen maddenin tanecikleri artık birbirinden tamamen kopar, bağımsız hareket etmeye başlar.
Kaynama noktası maddenin ayırt edici bir özelliğidir, çünkü her madde için değeri farklıdır.
Yoğunlaşma noktası (sıcaklığı) nedir?
Gaz halinde bulunan saf bir madde çevreye ısı verdiğinde enerjisi azalır ve yoğunlaşır. Yoğunlaşma da belli bir basınçta yalnızca belli bir sıcaklıkta gerçekleşir. Bu sıcaklığa yoğunlaşma noktası ya da sıcaklığı denir. Yoğunlaşma olayı sırasında maddenin sıcaklığı değişmez. Maddenin çevreye verdiği enerji taneciklerinin hareketinin yavaşlamasına değil, taneciklerin birbirine yaklaşmasına ve bağ yapmalarına neden olur. Moleküller arasındaki çekim kuvveti artar; madde sıvı hale dönüşür.
Aynı saf madde için aynı basınçta kaynama ve yoğunlaşma sıcaklıkları eşittir. Örneğin, suyun kaynama noktası da yoğunlaşma noktası da 1 atmosfer basınçta 100 °C’dir.
Basınç ile kaynama noktası ilişkisi nedir?
Kaynama ve yuğunlaşma noktalarında 1 atmosfer basınç vurgusu özellikle yapılmıştır. Deniz seviyesindeki hava basıncı olan 1 atm basınçtaki kaynama noktası, normal kaynama noktası olarak adlandırılır.
Basınç 1 atmosferden daha az olursa maddenin kaynama sıcaklığı azalır. Örneğin, yükseklikle birlikte hava basıncı azalır. Everest’e tırmanırken 5300 metre yükselikteki bir kampta su 82 °C’de kaynıyor.Şu videoda görebilirsiniz.
Ayrıca eğer suyu vakum pompasıyla havası azaltılan bir kubbenin içine yerleştirirseniz, suyun oda sıcaklığında kaynadığını görebilirsiniz. Bu videoya bakabilirsiniz.
Basınç 1 atmosferden daha fazla olursa maddenin kaynama noktası artar. Düdüklü tencereler de böyle çalışır. Isıtılınca buharlaşan su düdüklü tencerinin içinde hapsedilir. Buhar arttıkça tencerenin içindeki basınç artar. Basınç arttığı için su 121 °C’de kaynar. Bu yüzden yemekler daha hızlı pişer.

Buharlaşma ısısı nedir?
Buna kaynama ısısı değil buharlaşma ısısı deniyor. Saf bir maddenin sıvı halden gaz haline dönüşmesi için sağlaması gereken enerjinin birim kütleye oranına buharlaşma ısısı adı verilir. Lb simgesiyle gösterilir. Türetilmiş bir büyüklüktür ve skalerdir. Buharlaşma ısısının birimi cal/g ya da J/kg olarak verilir.
Buharlaşma ısısı maddenin ayırt edici bir özelliğidir; her madde için farklıdır.
Aşağıdaki grafik, sıvı haldeki saf bir maddeye ısı verildiğinde gerçekleşen olayları gösteriyor:
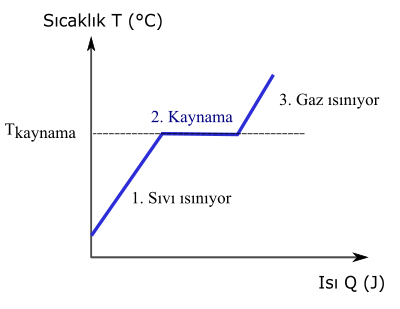
- Madde sıvı haldeyken ısı verilince sıcaklığı artıyor.
- Kaynama noktasına (Tkaynama) ulaştığında maddeye ısı verilmesine rağmen maddenin sıcaklığı değişmiyor, ama kaynamaya başlıyor.
- Kaynama tamamlandıktan sonra, yani maddenin tamamı sıvı halden gaz haline dönüştükten sonra, ısı verilmeye devam edildiği için, gaz halindeki maddenin sıcaklığı artmaya devam ediyor.
Bir saf maddenin kaynaması için verilmesi gereken ısı miktarıyla buharlaşma ısısının ilişkisini gösteren formül şöyledir.
Q = mLb
Q verilmesi gereken ısıyı, m maddenin kütlesini gösterir.
Buharlaşma ısısı basınç arttıkça azalır. (Kaynaklara bakınız.)
Yoğunlaşma ısısı nedir?
Saf bir maddenin gaz halinden sıvı hale dönüşmesi için çevresine vermesi gereken enerjinin birim kütleye oranına yoğunlaşma ısısı ya da yoğuşma ısısı denir. Ly simgesiyle gösterilir. Tıpkı buharlaşma ısısı gibi, yoğunlaşma ısısının da birimi cal/g ya da J/kg‘dir.
Aynı saf madde için buharlaşma ısısı, yoğunlaşma ısısına eşittir.
Lb = Ly
Örneğin, suyun buharlaşma ve yoğunlaşma ısısı 540 cal/g ya da 2260 J/kg’dır.
Çeşitli maddelerin kaynama noktaları ve buharlaşma ısıları
| Madde türü | Kaynama noktası (°C) | Buharlaşma ısısı (kJ / kg) | Buharlaşma ısısı (cal / g) |
|---|---|---|---|
| Alüminyum | 2450 | 11400 | 2723 |
| Bakır | 1187 | 5069 | 1211 |
| Demir | 3023 | 6340 | 1515 |
| Etil alkol | 78 | 850 | 203 |
| Gümüş | 2193 | 2336 | 558 |
| Kurşun | 1750 | 870 | 208 |
| Su | 100 | 2260 | 540 |
| Cıva | 357 | 295 | 70 |
Kaynama noktası ve buharlaşma ısısı ile ilgili Fizik dersi Kazanımları
9.5.2.1. Saf maddelerde hâl değişimi için gerekli olan ısı miktarının bağlı olduğu değişkenleri analiz eder.
- Deney veya simülasyonlardan yararlanarak değişkenler arasındaki ilişkiyi belirlemeleri sağlanır. Matematiksel model verilir. Matematiksel hesaplamalara girilmez.
Kaynaklar:
- Basınç buharlaşma ısısı ilişkisi. https://van.physics.illinois.edu/qa/listing.php?id=2461
- Düdüklü Tencere nasıl çalışır? https://www.hippressurecooking.com/how-the-pressure-cooker-works/
I like “FİZİK DERSİ”
you are a ”inek”
Yükselti artarsa yoğunlaşma noktası artar mı
Yükseklik artarsa basınç düşer, basınç düşerse kaynama (yoğuşma) noktası azalır.
Öz ısı büyük olan madde kaynama noktası büyüktür diyebilir miyiz?
Pek zannetmiyorum. Suyun ve buzun özısıları farklı örneğin.
Hocam Su Her ısıda Buharlaşır cümlesi doğru olmuş oluyor değil mi?
Veya kaç derecede kesinlikle buharlaşmaz diye de sormuş olmak isterim.
Yani mutlak buharlaşamama ısısı yani.
Teşekkür ederim…
Su her sıcaklıkta (ısıda değil, ısı başka bir şey) buharlaşır.
Hocam sıvılar içinde ilk önçe ısınan ve sonrasında sıçaklığını en son kaybetmeyen sıvı nedir
Amonyak kapalı sistemde ısınırsa patlama yaparmı basınç yaparmı 50-100 derecede
Eğer ki suyun kaynama noktası basınç ile doğru,erime noktası ise basınç ile ters orantılı ise yeterli miktarda basınç azaltılması ile suyun erime noktası ve kaynama noktasını aynı noktaya getirebilir miyiz? Getirirsek hal değişimleri bundan nasıl etkilenir?
Böyle özel bir basınç var. Suyun üçlü hali dediğimiz bir sıcaklık ve basınçta suyun her üç hali de aynı anda bulunuyor.